Неорганическая химия. Галогены
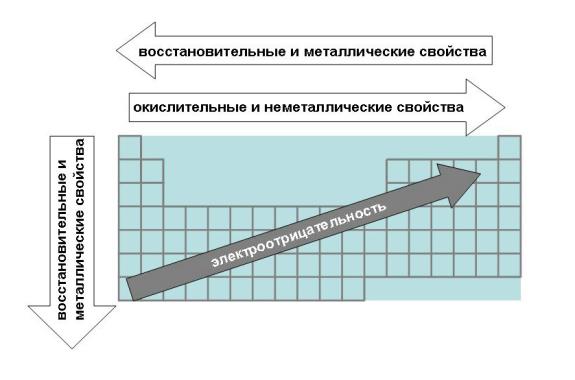
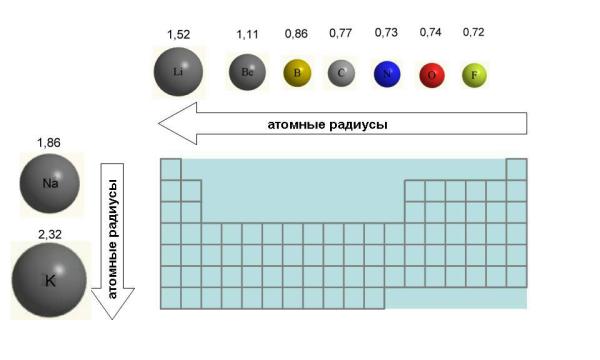
Периодическая система Д. Менделеева построена по двум основополагающим законам, именуемым периодическими. Вещества в таблице распределены по периодам. Чем больше период , тем более сильно проявляются металлические свойства элемента в пределах группы , соответственно, чем меньше период, тем меньше проявляются металлические свойства.

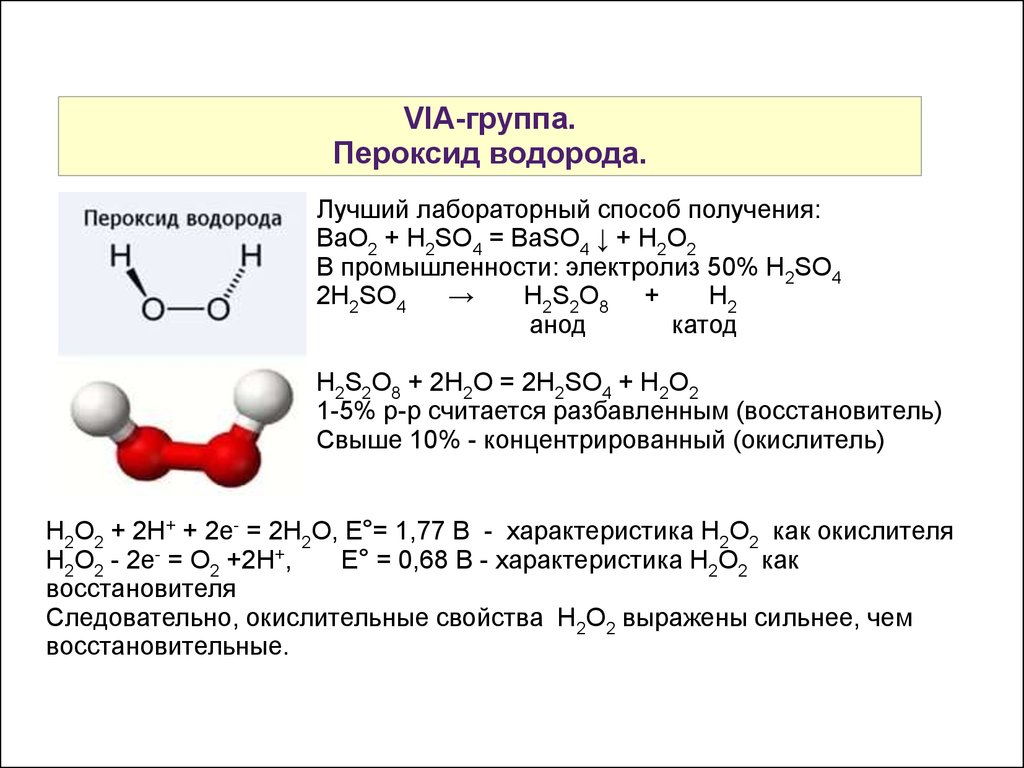








Менделеева по устаревшей классификации — элементы главной подгруппы VII группы [1]. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители , поэтому встречаются в природе только в виде соединений. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также формально искусственный элемент теннессин Ts. Все галогены — неметаллы , являются сильными окислителями. На внешнем энергетическом уровне 7 электронов.
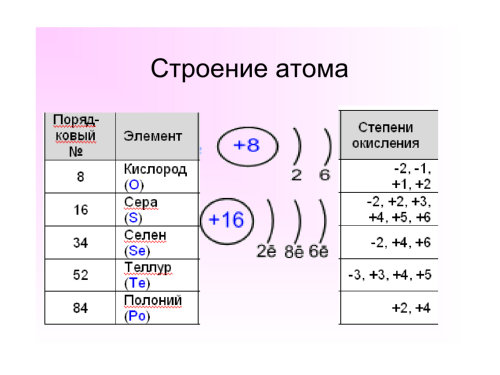

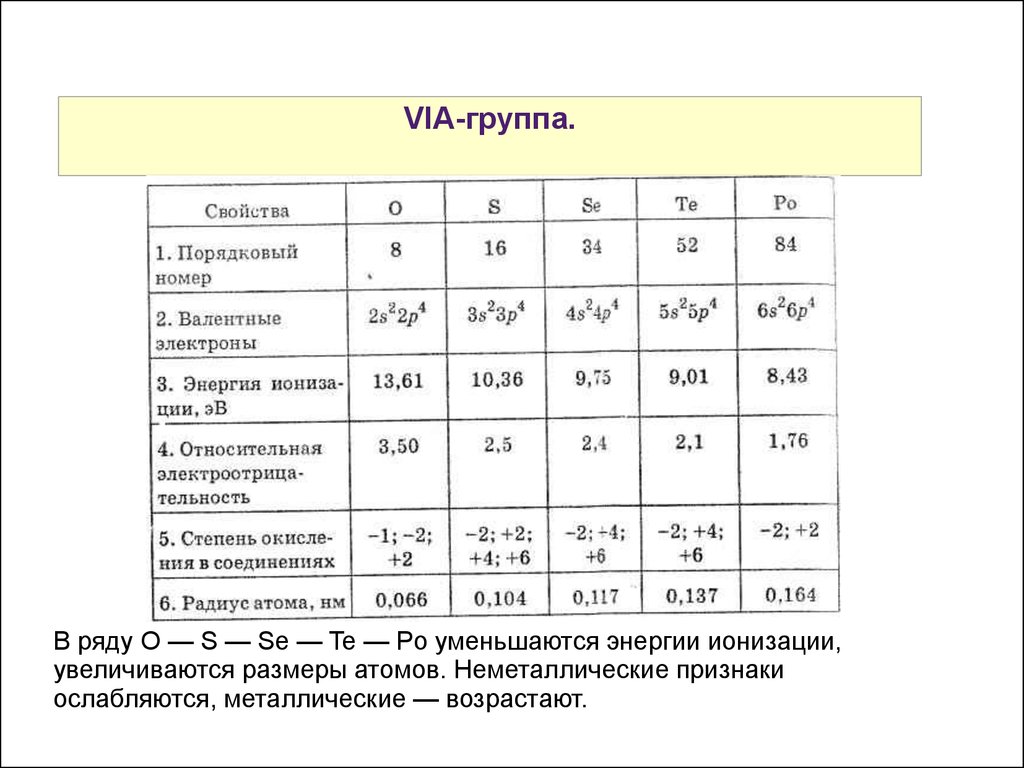



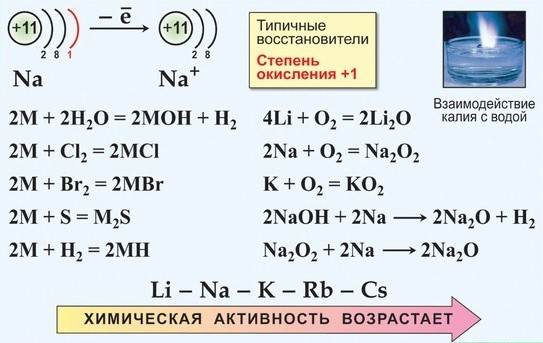


Категория: Химия. Похожие презентации:. Химия элементов VI группы главной подгруппы. Сера и ее соединения. Элементы VI группы главной подгруппы Халькогены.