Идеальный газ
В прошлой заметке я рассказывал о том, какие вопросы возникали у меня при чтении книжек о физике в частности — книги Айзека Азимова «Understanding Physics». Вот те из них, которые возникли у меня при чтении разделов, касающихся газов, температуры, теплоты и термодинамики:. Первое, от чего принято отталкиваться, давая определение понятия «температура», — это субъективное ощущение «тепло, холодно», которое возникает у нас, когда мы прикасаемся к тому или иному предмету.
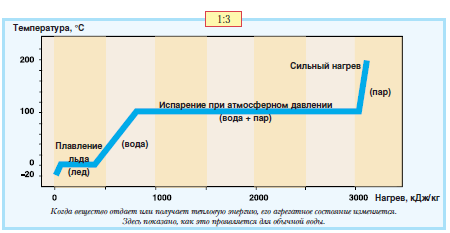





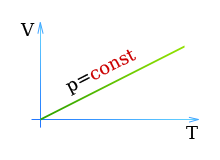

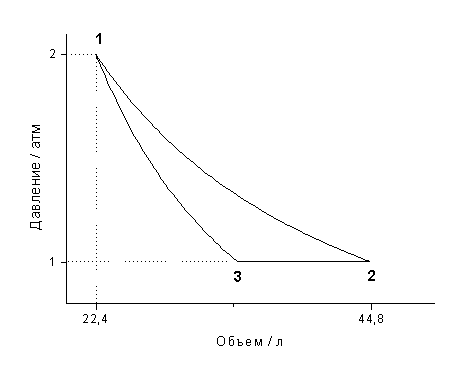

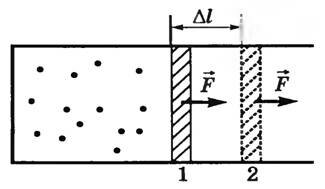

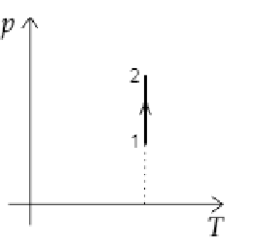
ЕГЭ Физика Задание ЕГЭ - Задание все задания. Задание Ответом к заданию по физике может быть целое число или конечная десятичная дробь записывайте её через запятую, вот так: 2,5. Версия для печати. Задание T








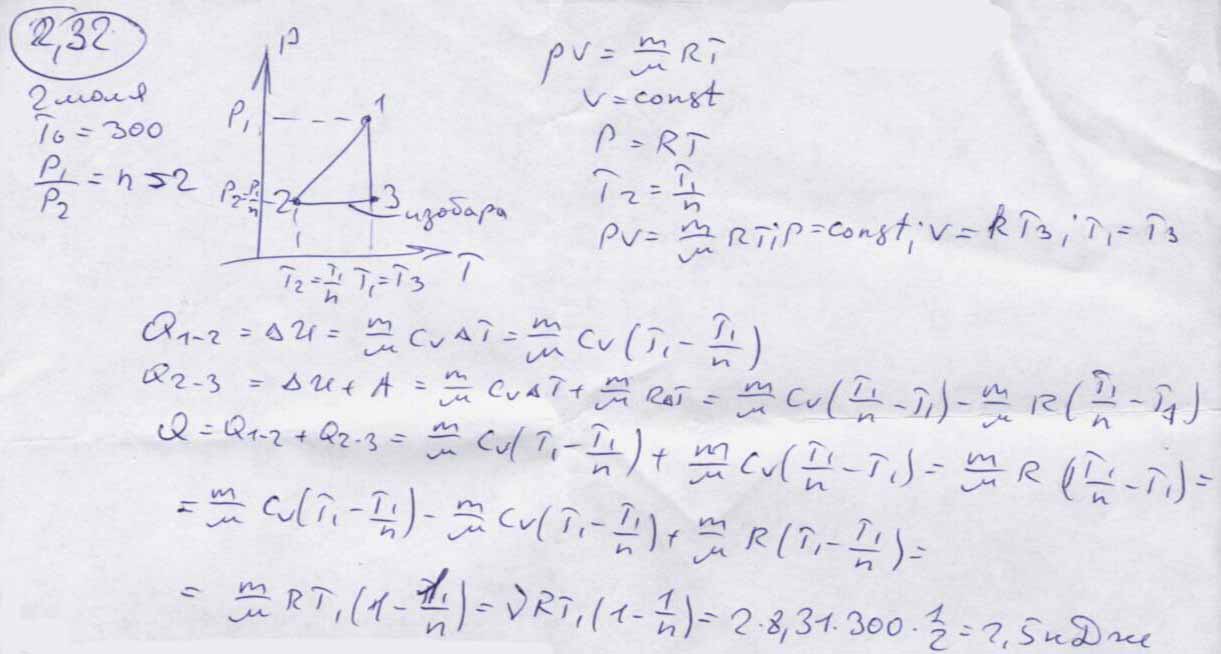
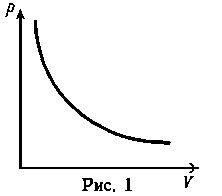
Идеальный газ - математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Уравнение политропного процесса имеет вид:.